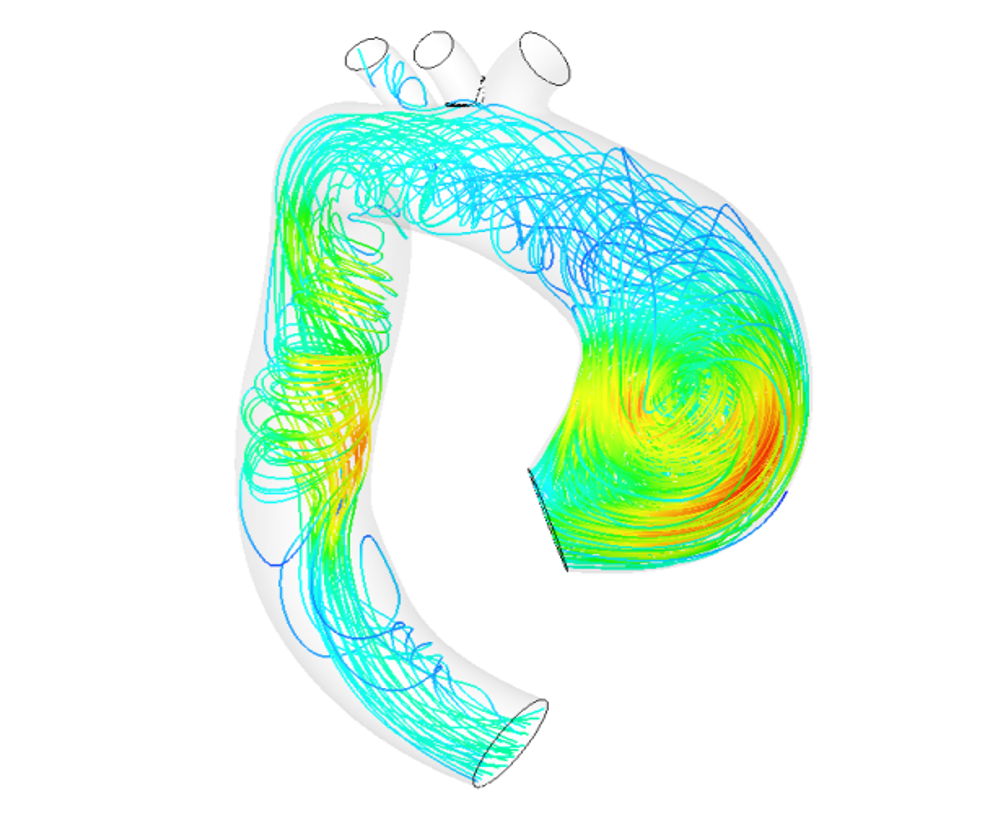
Vos recherches ont pour sujet la prévention des pathologies de l’aorte, et en particulier de la rupture d’anévrisme. Comment celle-ci se manifeste-t-elle ?
Stéphane Avril : L’aorte est la plus grosse artère de notre corps. Elle part du cœur et distribue le sang aux bras, au cerveau, elle redescend pour irriguer les viscères et se sépare en deux pour alimenter les jambes. La paroi de l’aorte est un peu comme notre peau. Elle est constituée quasiment des mêmes protéines et les tissus se ressemblent beaucoup. Avec la vieillesse, elle va donc se distendre. Ce phénomène peut être accéléré par d’autres facteurs, comme le tabac ou l’alcool. C’est un processus irréversible, qui a pour conséquence un agrandissement du diamètre de l’artère. Lorsque la dilatation est conséquente, on parle d’un anévrisme. C’est la pathologie de l’aorte la plus répandue. L’anévrisme peut rompre, ce qui est souvent létal pour la personne. En Europe, environ 15 000 décès par an sont causés par des ruptures d’anévrisme.
Sait-on anticiper l’apparition d’un anévrisme ?
SA : Non, il est très difficile de prédire où et quand un anévrisme va apparaître. Certains facteurs sont morphologiques. Par exemple, des anévrismes sont dus à une malformation de la valve aortique : 1 % de la population ne compte que deux des trois feuillets qui composent cette partie du cœur. À cause de cela, le sang est expulsé de manière moins régulière, ce qui induit une microblessure sur la paroi de l’aorte et favorise la dégradation. Une personne sur deux affectée par cette malformation développe un anévrisme et cela survient en général entre 40 et 60 ans. Il y a également des facteurs génétiques qui conduisent à des anévrismes plus tôt, entre 20 et 40 ans. Et puis les effets du vieillissement qui rendent les populations au-delà de 60 ans plus susceptibles de développer cette pathologie. Il est complexe d’établir la prédominance des facteurs les uns par rapport aux autres. D’autant que si à 30 ou 40 ans une personne est déclarée saine et se met à fumer par la suite, cela affectera l’évolution de l’aorte.
À défaut de pouvoir anticiper, peut-on soigner les anévrismes ?
SA : En biologie, la recherche fondamentale est très poussée sur le système aortique. Elle a permis de comprendre beaucoup de choses sur les mécanismes qui provoquent les anévrismes et leurs évolutions. Si les spécialistes ne peuvent pas prédire l’apparition, ils savent toutefois dire pourquoi la pathologie est apparue à tel endroit plutôt qu’un autre par exemple. Pour les patients déjà atteints d’un anévrisme, cela veut aussi dire que nous savons bien cerner les risques liés à l’évolution de la pathologie. Pour autant, il n’existe pas encore de médicament. Les solutions actuelles font plutôt appel à la chirurgie pour insérer une prothèse ou une endoprothèse — un stent recouvert d’un textile — et limiter ainsi les pressions sur la paroi endommagée de l’artère. Notre travail mené au sein de l’unité mixte de recherche Sainbiose [sous tutelles de l’INSERM, de Mines Saint-Étienne et de l’Université Jean Monnet], c’est de rassembler toutes les connaissances sur l’aorte et les anévrismes pour proposer des modèles numériques.
À quoi ces modèles numériques servent-ils ?
SA : Il faut voir le modèle comme un jumeau numérique 3D de l’aorte du patient. Nous pouvons faire des calculs dessus. Par exemple, nous étudions comment l’artère va naturellement évoluer, si les risques de rupture d’un anévrisme sont grands ou pas, et si oui à quel endroit de l’aorte exactement. Le modèle peut aussi servir pour analyser l’impact d’une prothèse sur l’anévrisme. Nous pouvons dire si la chirurgie sera véritablement efficace ou non, et aider le chirurgien à choisir le meilleur type de prothèse. Cette utilisation du modèle pour assister la chirurgie a d’ailleurs donné naissance à la start-up Predisurge créée en mai 2017. Des praticiens l’utilisent déjà pour prédire l’influence de l’opération et calculer les risques.
Comment procédez-vous pour construire ce jumeau de l’aorte ?
SA : Les premières données que nous utilisons sont celles de l’imagerie. Les patients passent des scanners et des IRM. Les IRM nous donnent notamment des informations sur la circulation du sang, car nous pouvons avoir 10 à 20 photos de la même zone sur la durée d’un cycle cardiaque. Nous avons donc des informations sur la compression et la dilatation de l’aorte lors des pulsations. En fonction de cette dynamique, nos algorithmes remontent à la géométrie de l’artère. En couplant cette donnée avec les mesures de pression, nous pouvons en déduire les paramètres qui pilotent le comportement mécanique de la paroi, et notamment l’élasticité. Ensuite, nous lions cela à la composition en élastine, en collagène et aux taux de cellules musculaires lisses de la paroi. Nous avons donc une idée très précise de tout ce qui constitue l’aorte du patient et de son comportement.
Les jumeaux numériques sont-ils destinés à tous les patients ?
SA : C’est un des gros challenges. Nous aimerions disposer d’un jumeau numérique pour chaque patient car cela nous permettrait de faire de la médecine personnalisée à grande échelle. Aujourd’hui ce n’est pas encore le cas. Pour l’instant nous travaillons avec des groupes de patients volontaires qui chaque année passent des examens de suivi dans le cadre d’une étude clinique pilotée par le CHU de Saint-Étienne. Nos modèles numériques viennent en plus des analyses des médecins, ce qui nous permet de les valider et d’échanger avec les professionnels sur ce qu’ils veulent pouvoir trouver grâce au jumeau virtuel de l’aorte. Nous savons qu’actuellement tous les patients ne peuvent pas bénéficier de cet outil. Analyser les données récoltées, construire le modèle 3D, mettre les bonnes propriétés biologiques pour chaque patient… tout cela nous prend trop de temps pour en faire une application à grande échelle. Ce que nous cherchons à faire en parallèle du développement de l’outil, c’est cerner les populations de patients pour lesquelles ce jumeau apporte le plus. Est-ce qu’il s’agit des patients pour lesquels l’anévrisme est causé par les facteurs génétiques ? Sur quelles tranches d’âge pouvons-nous avoir le plus d’impact ? Et nous voulons également aller vers l’automatisation pour rendre l’outil accessible à plus de patients.
Comment faire du jumeau numérique de l’aorte un outil à grande échelle ?
SA : L’idée serait d’intégrer beaucoup plus de patients dans notre phase de validation pour acquérir plus de données. À partir d’un grand volume de données il est plus facile d’aller vers l’intelligence artificielle pour automatiser leur traitement. Pour cela nous devons intégrer des études de suivi de grandes cohortes de patients. Il faut donc passer à l’échelle d’une plateforme qui intègre des médecins, des chirurgiens, des chercheurs, mais aussi des fabricants de dispositifs d’imagerie, car c’est de là que viennent les données. Cela permettrait de créer un dialogue entre toutes les parties prenantes, de montrer aux professionnels l’impact réel de la modélisation de l’aorte. Nous avons déjà des partenariats avec d’autres écoles du réseau IMT : Télécom SudParis et Télécom Physique Strasbourg. Avec eux, nous améliorons l’état de l’art en matière de techniques de traitement des images. Nous cherchons à présent à intégrer des professionnels de l’imagerie. Pour faire monter l’outil en échelle, il faut aussi que le projet prenne de l’ampleur. Et c’est ce que nous nous attachons à faire.